Cientistas descobrem estratégia de sobrevivência de células cancerosas
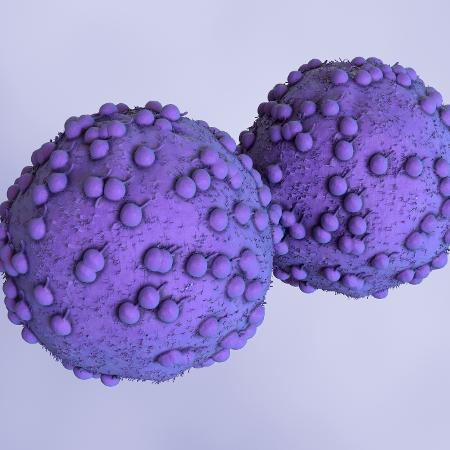
Alguns tipos de câncer não respondem aos tratamentos convencionais, como quimioterapia e radioterapia, por terem diferentes “estratégias” de sobrevivência. Mas cientistas da Universidade do Colorado (EUA) desvendaram o mecanismo que as células cancerosas usam para se autopreservar. A descoberta pode contribuir no futuro para tratamentos mais efetivos contra tumores.
O estudo partiu de dois mecanismos celulares: a autofagia e apoptose. Basicamente, a função deles é quebrar material celular que não seja mais útil. Mas, enquanto a apoptose leva essa desmontagem até o final, provocando a morte da célula, na autofagia, a morte é adiada através da reciclagem do material celular.
Veja também:
- Masturbar-se todo dia evita câncer de próstata?
- Vitamina D pode proteger contra alguns tipos de câncer
- Resistência dos elefantes ao câncer pode ajudar no combate à doença
Os pesquisadores descobriram que a quimioterapia e a radioterapia podem aumentar a presença de autofagia em células cancerosas, o que realmente lhes permite entrar em um modo de "hiato", que as ajuda a evitar a morte e retomar sua atividade mais tarde.
Agora, os cientistas querem desenvolver uma nova estratégia para evitar a autofagia e desencadear a morte das células de câncer de forma mais eficiente. Os resultados do estudo já foram publicados na revista Developmental Cell.
Os pesquisadores explicam que o vínculo entre autofagia e apoptose é o fator de transcrição FOXO3a, uma proteína que traz "instruções" sobre o que deve ocorrer no nível celular.
"O problema é que muitos tratamentos contra o câncer empurram as células cancerosas até a morte. Mas elas usam a autofagia para entrar em pausa e evitarem a morte. Nós não queremos que as células cancerosas parem, queremos que elas morram. E a FOXO3a pode fazer a diferença entre esses dois resultados", explica Andrew Thorburn, líder do estudo.
A FOXO3a regula a autofagia, que, curiosamente, também ajuda a regular os níveis desse fator de transcrição. Em outras palavras, quanto mais autofagia na célula, os níveis de FOXO3a diminuem. Quando há pouca autofagia, há maior produção de FOXO3a, aumentando assim o processo de reciclagem celular. Isso significa que a autofagia permanece em níveis constantes, apesar da ação de drogas de quimioterapia.
Pesquisas anteriores revelaram que outra proteína --conhecida como PUMA-- é a que "fala" para as células quando é necessário se autodestruir. Agora, Thorburn e sua equipe também descobriram que a FOXO3a pode aumentar a expressão do gene que impulsiona a produção de PUMA.
Quando a autofagia é inibida, mais FOXO3a é produzida, e quando isso acontece, os níveis elevados de FOXO3a aumentam a presença de autofagia em células cancerosas de novo. Mas, ao mesmo tempo, o fator de transcrição eleva a presença de PUMA, que impulsiona a morte celular.
Após essas descobertas, os cientistas queriam saber se poderiam usar esses mecanismos para tornar as células de câncer mais vulneráveis à morte. A estratégia envolveu o uso de inibidores de autofagia combinado com um medicamento supressor de tumores chamado Nutlin.
Embora a droga seja conhecida por limitar o crescimento de células cancerosas, não havia associação com desencadear a morte celular. Assim, os pesquisadores queriam saber se, ao associá-lo com inibidores de autofagia, a apoptose seria feita de forma mais eficiente.
A razão pela qual Thorburn e colegas decidiram testar as terapias combinadas é porque tanto a inibição de autofagia como a Nutlin são conhecidas por aumentar a produção de PUMA.
Depois de analisar uma série de testes realizados em culturas de células e em ratos, os pesquisadores viram que a estratégia funcionou. "O [resultado] foi que transformamos uma droga que poderia retardar o crescimento tumoral, mas não podia matar as células de câncer em uma substância capaz de fazer isso", afirmou Thorburn.
SIGA O VIVABEM NAS REDES SOCIAIS
Facebook: https://www.facebook.com/VivaBemUOL/
Instagram: https://www.instagram.com/vivabemuol/
Inscreva-se no nosso canal no YouTube: http://goo.gl/TXjFAy









ID: {{comments.info.id}}
URL: {{comments.info.url}}
Ocorreu um erro ao carregar os comentários.
Por favor, tente novamente mais tarde.
{{comments.total}} Comentário
{{comments.total}} Comentários
Seja o primeiro a comentar
Essa discussão está encerrada
Não é possivel enviar novos comentários.
Essa área é exclusiva para você, assinante, ler e comentar.
Só assinantes do UOL podem comentar
Ainda não é assinante? Assine já.
Se você já é assinante do UOL, faça seu login.
O autor da mensagem, e não o UOL, é o responsável pelo comentário. Reserve um tempo para ler as Regras de Uso para comentários.